Radioaktiva läkemedel – nyckeln till framtidens cancervård?

Marika Nestor och hennes forskargrupp har tagit ett nytt steg inom cancerprecisionsmedicinen med ett helt nytt radioaktivt läkemedel. Foto: Mikael Wallerstedt.
Precisionsmedicin beskrivs ofta som framtidens vård och ett effektivt sätt att skapa en mer individanpassad behandling. Just cancerbehandling är ett område där precisionsmedicin kan komma att tjäna ett gott syfte och en viktig behandlingsform kan komma att bli radioaktiva läkemedel som professor Marika Nestor och hennes forskargrupp arbetar med.
Att Marika Nestor, professor i biomedicinsk strålningsvetenskap vid institutionen för immunologi, genetik och patologi, skulle börja forska och arbeta med radioaktiva läkemedel och cancerprecisionsmedicin var inte självskrivet. Men med en examen från civilingenjörsprogrammet i molekylär bioteknik har det visat sig att området passar perfekt.
– I grunden, ända sedan jag var liten, har jag gillat att uppfinna, klura och lösa saker. Efter att ha gjort exjobbet visste jag att jag ville göra någon slags medicinsk forskning och kände att just cancerforskning var relevant för att det är en sjukdom som alla drabbas av, antingen direkt eller via att någon anhörig blir sjuk, berättar hon och fortsätter.
– Sedan tyckte jag tidigt att det här med radioaktivitet kopplat till behandling var intressant och häftigt, samtidigt som det innehåller flera delar och moment från det jag studerade på universitetet.
Precisionsmedicin är framtidens vård
Nu är det just inom det området som Marika och hennes forskargrupp arbetar. Radioaktiva läkemedel handlar om att med hjälp av cancer-målsökande molekyler, exempelvis en antikropp, med en ”påkopplad” radionuklid både hitta och behandla cancern mer precist och exakt. Helt enkelt det som kallas för precisionsmedicin och som många, inklusive Marika Nestor, ser som framtiden.
– Det är åt det hållet vi rör oss och som vi måste röra oss när det gäller mer komplicerade sjukdomar som cancer. Långt ifrån alla botas idag och får därmed ofta onödig behandling. Läkemedlen är dessutom dyra och därför behövs metoder som precisionsmedicin för att redan från start få reda på varje individuell patients förutsättningar för att kunna anpassa behandlingen. Den processen i sig kan också bli dyr, men precisionen man uppnår kommer att göra att det tjänas in. Sammantaget är fördelarna många, menar hon.
Med PET- eller SPECT-kamera kan man se var molekylerna man administrerat i patienten har hamnat, och om de ansamlats som tänkt i hög grad i tumören jämfört med ”normalorganen”. Foto: Johan Alp.
Just utifrån aspekten att se på varje patient individuellt för att anpassa behandlingen efter just den specifika cancerformen och tumören är radioaktiva läkemedel något som väcker stort hopp inför framtiden. För det är inte bara ett behandlande läkemedel, utan kan också användas för så kallad ”imaging”.
– Radioaktiva läkemedel som vi forskar på har den fördelen att de kan användas både för att först hitta och karaktärisera tumören och eventuella metastaser, för att därefter användas terapeutiskt, alltså för behandling. Det hela beror på vilken radionuklid som kopplas på den målsökande molekylen. En del radionuklider avger strålning som du kan detektera utanför kroppen med PET- eller SPECT-kamera. Man ser då var molekylerna man administrerat i patienten har hamnat, och om de ansamlats som tänkt i hög grad i tumören jämfört med ”normalorganen”, förklarar Marika och fortsätter.
– När man via imaging kunnat slå fast att cancermålsökningen fungerat kan man gå vidare och ge samma patient behandling med en terapivariant av samma läkemedel, där man alltså har bytt ut imaging-radionukliden mot en variant med en annan typ av strålning som är mera behandlande. Då kommer molekylerna som fäster på cancercellerna i tumören sitta där och avge strålning. Det blir helt enkelt som en fokuserad strålterapi som sker inuti kroppen, koncentrerad till just tumören eller tumörerna.
Men hur ”vet” molekylerna då vart de ska ta vägen? Hur hittar de fram till tumören? Svaret ligger i cellernas yta i kroppen.
– Det är ju inte så att molekylerna med radionukliden så att säga lockas till tumören. Det handlar om skillnader i normalcellernas och cancercellernas yta. Cancercellen kan exempelvis ha väldigt mycket mer av vissa tillväxtreceptorer för att kunna växa och dela sig. Dessa kan man använda som måltavlor och designa molekyler som passar och binder till just den måltavlan. Molekylen kan bestå av en antikropp som är gjord för att hitta just en sak. De åker runt i blodet tills de hittar sin måltavla och fäster till den.
Hur intensiv strålningen från radionukliderna som fästs på molekylerna är beror på vilken radionuklid man använder sig av.
”Forskare som hör till världseliten”
För hennes forskargrupp ser det lovande ut och faktum är att ett läkemedel som tagits fram vid SciLifeLab i Uppsala ska in i klinisk prövning under året, men vi ska återkomma till den saken. Först kan vi konstatera att Uppsala universitet och Akademiska sjukhuset ligger långt framme på området och inom cancerprecisionsmedicin i stort.
– Min uppfattning är att vi ligger långt framme och har forskare här som hör till världseliten. Vi är väldigt duktiga på att få in saker på kliniken och ett exempel på det är CAR-T-celler som Uppsala var först i Europa med i behandling. Mixen av grundforskning och den translationella forskningen som kommer ut i kliniska prövningar är god. För min egen del som arbetar med imaging så är vi också långt framme och har en stark tradition där med PET-centrum. Vi har tillgång till fantastiska miljöer och faciliteter här som skapar väldigt bra förutsättningar att ligga långt framme inom viktiga forskningsområden.
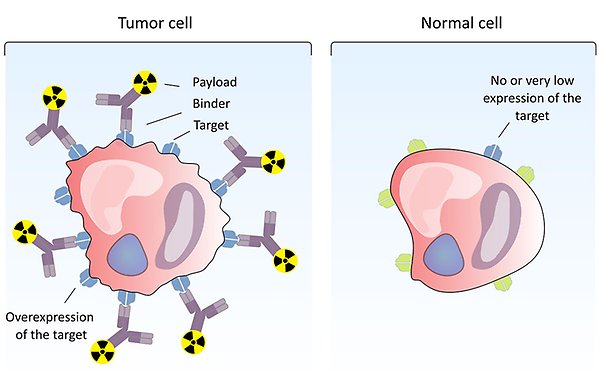
En radioaktivt inmärkt substans binder till en målmolekyl som det finns mycket av på tumörceller men som saknas helt eller bara finns i mycket liten mängd på normala celler. Det gör att radionuklider kommer att ackumulera på tumörcellerna men inte i normal vävnad. Illustration: Diana Spiegelberg.
Nya patent väcker hopp
Idag finns två radioaktiva läkemedel som är godkända för användning i Sverige: Lutathera och Pluvicto. Den förstnämnda behandlar neuroendokrina tumörer (NET) och har visat att behandling kan förlänga livet. Pluvicto används för att upptäcka prostatacancer. Men fler är på gång och det leder in på det läkemedel som Marika varit med och tagit fram.
– Ett av de projekt vi haft här på SciLifeLab i Uppsala har handlat om att vi tagit fram en antikropp märkt med en radionuklid för molekylär behandling av framför allt anaplastisk sköldkörtelcancer, men även andra former. Den kommer att gå in i en klinisk prövning nu under året.
För detta ändamål har Marika Nestor varit med och startat företaget Akiram Therapeutics.
– Vi insåg att det var något vi inte skulle klara av inom forskningsverksamheten med de kostnader som kliniska prövningar innebär. Så vi skaffade oss patent på den här molekylen och la det i ett bolag istället. Det har varit en ny och spännande resa.
Varför valde ni just sköldkörtelcancer?
– Det var den cancerformen där vi ansåg att det fanns störst medicinskt behov, eftersom det just för anaplastisk sköldkörtelcancer inte finns någon bot idag. Det är en av de värsta cancerdiagnoserna du kan få, med en medelöverlevnad på bara några månader efter diagnos. När måltavlan jag arbetade med visade sig finnas i just anaplastisk sköldkörtelcancer blev det naturligt att ha den cancerformen som utgångspunkt för vårt arbete.
Vart det hela kommer att leda är svårt att sia om på ett så här tidigt stadium. Det enda som finns att gå på är resultaten från djurmodeller, där näst intill alla djur har botats med endast en dos.
– Men det är en orättvis modell och går inte att överföra. En människa är inte en 70-kilos mus, utan just en människa. Det kommer att se annorlunda ut. Vår prövning i år kommer till största delen att handla om själva farmakokinetiken och säkerheten runt läkemedlet. Men vi hoppas också att via kamera kunna se att läkemedlet ansamlas i tumören hos patienten och därefter också kanske kunna ge ytterligare doser för att se någon terapeutisk effekt. Ser man till de läkemedel som är godkända idag har de effekt, men det är inte så att alla botas. Vi hoppas på att se väldigt god respons hos vissa, medan det blir mer bromsande effekt hos andra, så det finns fortfarande behov av att saker runt omkring som kan stärka effekten ytterligare och det är nästa steg, avslutar Marika Nestor.
Robin Widing
